Izinkan EUA vaksin Sinovac, BPOM: Efikasi 65,3%
BPOM tetap akan memantau terhadap keamanan vaksin Covid-19 dalam jangka panjang.
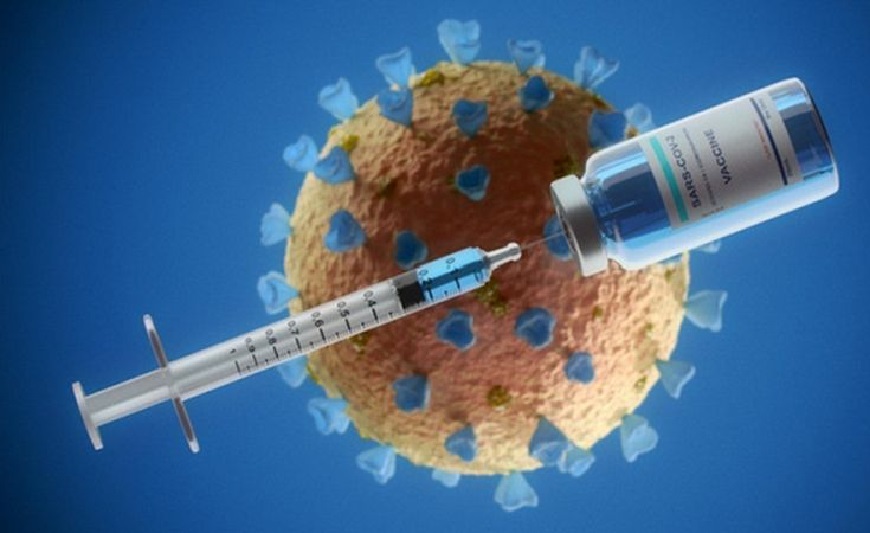
Badan Pengawas Obat dan Makanan (BPOM) memberikan persetujuan izin penggunaan darurat (emergency use authorization/EUA) kepada vaksin Covid-19 asal Sinovac, China.
“Maka vaksin Coronavac ini memenuhi persyaratan untuk diberikan persetujuan dipergunakan dalam kondisi emergency use authorization. Oleh karena itu, pada hari ini, Senin (11/1), Badan POM memberikan persetujuan penggunaan dalam kondisi emergency use authoriziation untuk pertama kali kepada vaksin coronavac produksi Sinovac bekerja sama dengan PT Bio Farma,” ujar Kepala BPOM Penny Kusumastuti Lukito, dalam keterangan pers virtual, Senin (11/1).
Pengambilan keputusan persetujuan dikeluarkannya EUA berdasarkan rekomendasi dari hasil rapat pleno Komite Nasional Penilai Obat, Indonesia Technical Advisory Group on Immanuization (ITAGI), dan para ahli epidemiologi, Minggu (10/1) kemarin.
Pengambilan keputusan setelah melewati evaluasi dan diskusi komprehensif dengan dukungan data yang bisa menjamin aspek keamanan, khasiat, dan mutu. “Badan POM senantiasa mengedepankan integritas dan independensi serta keselaatan masyarakat,” ucapnya.
Efikasi (kemanjuran) vaksin Covid-19 asal Sinovac hanya 65,3%. Namun, BPOM memberi persetujuan terhadap vaksin ini disebabkan sudah sesuai dengan standar Organisasi Kesehatan Dunia (WHO) atau di atas 50%.
“Hasil uji klinis di Bandung menunjukkan harapan bahwa vaksin ini mampu menurunkan kejadian Covid-19. Ini akan sangat berarti dalam upaya kita ke luar dari krisis Covid-19,” tutur Penny.
Sebelumnya, BPOM telah menerima laporan hasil uji klinis vaksin Sinovac dari PT Bio Farma-Unpad. BPOM melakukan kajian dengan membandingkan dengan laporan serupa dari Brasil dan Turki sebagai pertimbangan EUA. EUA merupakan izin sementara yang diterbitkan otoritas berwenang untuk penggunaan obat ataupun vaksin secara terbatas.
BPOM mengacu pada pedoman dan Badan Pengawas Obat Eropa (EMA) dalam pemberian EUA. Penerbitannya mesti didukung WHO dari segi keamanan, khasiat, dan mutu yang memadai.
Selain itu, vaksin Covid-19 harus memiliki data uji klinis fase 1 dan 2 secara lengkap dalam enam bulan pemantauan. Juga data interim fase 3 untuk menunjukkan khasiat dan keamanan.
"Kami sedang menunggu data dari Bandung untuk interim tiga bulan yang akan diberikan tiga bulan. Kami juga akan menggunakan data dari Turki dan Brasil,”ucapnya.
Usai menerbitkan EUA, BPOM tetap akan memantau terhadap keamanan vaksin Covid-19 dalam jangka panjang. BPOM juga memberikan pendampingan kepada Dinas Kesehatan terkait penyimpanan vaksin Covid-19, agar tetap sesuai prosedur distribusi obat yang baik.

Derita jelata, tercekik harga pangan yang naik
Senin, 21 Feb 2022 17:25 WIB
Menutup lubang “tikus-tikus” korupsi infrastruktur kepala daerah
Minggu, 13 Feb 2022 15:06 WIB
Segudang persoalan di balik "ugal-ugalan" RUU IKN
Minggu, 23 Jan 2022 17:07 WIB
Ironi hilirisasi: Glorifikasi di balik nestapa masyarakat
Selasa, 23 Jan 2024 18:50 WIB
Mewujudkan e-commerce inklusif bagi penyandang disabilitas
Kamis, 30 Nov 2023 16:09 WIB